|
1.- Un poco de historia Al igual que en Boyle y Mariotte, hay que aclarar
que, Jacques Alexandre César Charles y Joseph Louis Gay-Lussac, eran dos
personas distintas que estudiaron la misma ley que más adelante
desarrollaremos. Jacques Alexandre César Charles era un físico y
químico francés que nació en Beaugency en el año 1.746 . Fue profesor de
física en el Conservatorio de Artes y Oficios de París y en el año 1.783 construyó
el primer globo aerostático con el que voló a una altura superior a los 500
metros, procediendo a estudiar la variación de la temperatura con la altitud
entre otras cosas. En 1.802 hizo públicos los descubrimientos que
hizo realmente en 1.787 sobre la variación del volumen de un gas con respecto
a la temperatura y a presión constante. Estos descubrimientos han perdurado
hasta nuestros días con el nombre de Ley de Charles y Gay Lussac. Finalmente, en el año 1.795 pasó a formar parte
de la Real Academia de las Ciencias y murió en París en 1.823 a la edad de 77
años Joseph Louis Gay-Lussac era un físico francés que nació en Saint Léonard
de Noblat en el año 1.778 En 1.802 experimentó la teoría de Charles de que
todos los gases sufren la misma variación de volumen para una misma variación
de temperatura a presión constante. A esta variación la llamó Coeficiente
Térmico y fue la base para la escala térmica desarrollada años más tarde por
Kelvin. También ascendió en globo en 1.804 y descubrió
que a partir de cierta altura el campo magnético y la composición del
aire son constantes. En 1.808 publico la ley de Gay Lussac por la que
se establece que cuando dos gases reaccionan entre sí en condiciones iguales
de temperatura y presión, sus volúmenes correspondientes guardan relación,
consolidándose de esta manera la Ley de Charles y Gay Lussac. Finalmente murió en París en el año 1.850 a la
edad de 72 años. 2.- La ley La ley que estos dos científicos postularon,
viene a decir que, a presión constante, el volumen de un gas dado varía de
forma proporcional a la temperatura, es decir, si sube la temperatura aumenta
el volumen y viceversa. Matemáticamente, la ley viene expresada por la
fórmula:
Donde: V = Volumen T = Temperatura K = Constante cuyo valor
es 1 / 273 Es decir, por cada grado que aumentamos la
temperatura de un gas, este aumenta su volumen en un 0,366 % Según esto, podríamos calcular cual sería el volumen
final de un gas al variar su temperatura, manteniendo la presión constante. Siendo: Vt = Volumen final V0 = Volumen inicial Tenemos:
(volumen final es igual a volumen inicial más el incremento del volumen inicial) Ahora bien: Sustituyendo: Sacando factor común: Operando la ecuación: Ahora bien, si nos fijamos: 273 + t = T (temperatura en
grados Kelvin) Entonces: Finalmente: (siendo K = V0 / 273) O lo que es lo mismo: (Esta es la primera ley de Gay -Lussac) Razonando de la misma manera, llegaríamos a la
segunda ley de Gay-Lussac que postula que a volumen constante, la presión de
un gas dado varía de forma proporcional a la temperatura, es decir, si sube
la temperatura aumenta la presión y viceversa. Matemáticamente, la ley viene
expresada por la fórmula: Bien, y ¿para que todo esto? Paciencia y sigamos.
¿Recordamos la ley de Boyle y Mariotte? (constante) Despejando: Veamos la ley de Boyle y la ley de
Gay-Lussac juntas (Boyle) (Gay-Lussac con K = V0 / 273) Si combinamos ambas ecuaciones obtendremos: O lo que es lo mismo: Siendo: P = Presión Absoluta V = Volumen T = Temperatura en
grados Kelvin (grados centígrados + 273) Una vez explicada la ley de Charles y Gay-Lussac,
vamos a ver con un ejemplo práctico cuales son las implicaciones en el mundo
del buceo. 3.- Un ejemplo de La ley de Gay-Lussac Supongamos que queremos hacer una inmersión con
una botella de 12 litros. Esta inmersión nos llevará a 22 metros de profundidad
con una duración de 35 minutos. Vamos a ver su planificación en cuanto a
consumo de aire se refiere. Consideraremos el tiempo de inmersión al tiempo
que transcurre desde que metemos la cabeza en el agua hasta que la sacamos.
Así mismo consideraremos para este ejemplo que el buzo en cuestión tiene un
consumo en superficie de 20 litros por minuto y que por supuesto realiza la
parada de seguridad de 3 minutos a 5 metros. Dicho esto, procedemos a descomponer la inmersión
por tiempos: (A) Tiempo en el descenso
......................................................................................
2 minutos (B) Tiempo de permanencia en el
fondo ............................................................ 27 minutos (C) Tiempo en el ascenso hasta la
parada de seguridad ................................ 2 minutos (D) Tiempo en parada de seguridad
..................................................................... 3
minutos (E) Tiempo en ascenso final a
superficie desde la parada ............................. 1 minutos TIEMPO TOTAL DE LA INMERSION
..................................................................... 35 MINUTOS Ahora calculamos el consumo de nuestro buceador
en cada tramo de la inmersión: CONSUMO TOTAL ESTIMADO EN LA INMERSION = 2.021 Litros CAPACIDAD DE LA BOTELLA Presión x Litros Botella = 200 BAR x 12 Litros = 2.400 Litros QUEDAN EN LA BOTELLA Capacidad - Consumo = 2.400 Litros - 2.021 Litros = 379 Litros Como sabemos, deberíamos salir con 50 Bares de
presión, que equivalen en esta botella a 600 Litros de aire. Está claro que
aunque en principio nos pueda parecer que podemos hacerla, no deberíamos
intentarlo. De hecho, no hemos tenido en cuenta las posibles
variaciones de temperatura. Es ahora, cuando por fin vamos a conocer una de
las implicaciones de Charles-Gay Lussac en el buceo. Recordemos la fórmula: Ahora supongamos que la botella de 12 litros de
nuestro buzo ha sido cargada a 200 Bares y a una temperatura de 23 grados
Celsius --esto
no es nada raro y más aún cuando hay centros que no controlan lo suficiente
la temperatura de carga-- y el agua donde se realizará la
inmersión se encuentra en un pantano a 10 grados Celsius. En el momento de recoger la botella el manómetro
marca 200 Bares, por lo que el buceador presupone que dispone de 2.400 litros
de aire y da por hecho que no tiene porqué haber problemas para realizar la
inmersión. !!!Nada más lejos de la realidad!!! Aplicando a Gay-Lussac tenemos: P1 = 200 + 1 = 201 Bares (recordemos
que es presión absoluta) V1 = 12 Litros T1 = 23 + 273 = 296 grados Kelvin P2 = ??? V2 = 12 Litros T2 = 10 + 273 = 283 grados Kelvin Pero recordemos que este resultado corresponde a
la presión absoluta, por lo que tendremos que restarle la presión
atmosférica, quedando: Presión absoluta - Presión Atmosférica = Presión
Botella ===> 191 Bares Luego en la botella el nuevo volumen de aire
será: 191 Bares x 12 Litros = 2.292 Litros Que nada tienen que ver con los supuestos 2.400
litros de un principio, lo cual nos lleva a salir bastante mas ajustados ante
una contingencia, por no hablar de la diferencia que tendríamos en el buceo
bajo hielo. Hasta aquí ha llegado este breve resumen de la
Ley de Charles y Gay-Lussac y algunas de sus implicaciones en el mundo del
buceo. Tan solo decir que este desarrollo se presupone para gases de los
llamados Ideales, sufriendo pequeñas variaciones a peor al trabajar con gases
reales como el aire. |



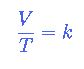




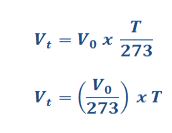








No hay comentarios:
Publicar un comentario